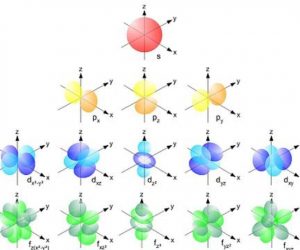
电子配置是通过将原子或离子的所有电子定位在它们的轨道或能量子能级中来编写的。
回想一下,有 7 个能级:1、2、3、4、5、6 和 7。每个能级又具有多达 4 个称为 s、p、d 和 f 的子能级。
因此,级别 1 仅包含子级别 s; 级别 2 包含 syp 子级别; 级别 3 包含子级别 s、p 和 d; 级别 4 到 7 包含子级别 s、p、d 和 f。
电子构型

为了计算不同能级的电子分布,Electron configuration 将量子数作为参考或简单地使用它们来进行分布。 这些数字使我们能够描述电子或单个电子的能级,它们还描述了它在空间电子分布中感知到的轨道形状。
元件配置表
| 元素名称 | 图形符号 | 原子数 | 电负性 |
|---|---|---|---|
| 锕 | [Ac] | 89 | 1.1 |
| 铝材料 | [Al] | 13 | 1.61 |
| 銤 | [Am] | 95 | 1.3 |
| 锑 | [Sb] | 51 | 2.05 |
| 氩 | [Ar] | 18 | |
| 砷 | [As] | 33 | 2.18 |
| 砹 | [At] | 85 | 2.2 |
| 钡 | [Ba] | 56 | 0.89 |
| kel | [Bk] | 97 | 1.3 |
| 铍 | [Be] | 4 | 1.57 |
| 铋 | [Bi] | 83 | 2.02 |
| hr | [Bh] | 107 | |
| 硼 | [B] | 5 | 2.04 |
| 溴 | [Br] | 35 | 2.96 |
| 镉 | [Cd] | 48 | 1.69 |
| 钙 | [Ca] | 20 | 1 |
| 锎 | [Cf] | 98 | 1.3 |
| 碳 | [C] | 6 | 2.55 |
| 铈 | [Ce] | 58 | 1.12 |
| 铯 | [Cs] | 55 | 0.79 |
| 氯 | [Cl] | 17 | 3.16 |
| 铬 | [Cr] | 24 | 1.66 |
| 钴 | [Co] | 27 | 1.88 |
| 铜 | [Cu] | 29 | 1.9 |
| 锔 | [Cm] | 96 | 1.3 |
| 达姆施塔特大厦 | [Ds] | 110 | |
| b | [Db] | 105 | |
| 镝 | [Dy] | 66 | 1.22 |
| 鑀 | [Es] | 99 | 1.3 |
| 铒 | [Er] | 68 | 1.24 |
| 铕 | [Eu] | 63 | |
| 镄 | [Fm] | 100 | 1.3 |
| 氟 | [F] | 9 | 3.98 |
| 钫 | [Fr] | 87 | 0.7 |
| 钆 | [Gd] | 64 | 1.2 |
| 镓 | [Ga] | 31 | 1.81 |
| 锗 | [Ge] | 32 | 2.01 |
| 黄金 | [Au] | 79 | 2.54 |
| 铪 | [Hf] | 72 | 1.3 |
| s | [Hs] | 108 | |
| 氦 | [He] | 2 | |
| 钬 | [Ho] | 67 | 1.23 |
| 氢 | [H] | 1 | 2.2 |
| 铟 | [In] | 49 | 1.78 |
| 碘 | [I] | 53 | 2.66 |
| 铱 | [Ir] | 77 | 2.2 |
| 铁 | [Fe] | 26 | 1.83 |
| 氪 | [Kr] | 36 | 3 |
| 镧 | [La] | 57 | 1.1 |
| 劳伦草属 | [Lr] | 103 | |
| 铅 | [Pb] | 82 | 2.33 |
| 锂 | [Li] | 3 | 0.98 |
| 镏 | [Lu] | 71 | 1.27 |
| 镁 | [Mg] | 12 | 1.31 |
| 锰 | [Mn] | 25 | 1.55 |
| 䥑 | [Mt] | 109 | |
| 钔 | [Md] | 101 | 1.3 |
| 水星 | [Hg] | 80 | 2 |
| 钼 | [Mo] | 42 | 2.16 |
| 钕 | [Nd] | 60 | 1.14 |
| 氖 | [Ne] | 10 | |
| 镎 | [Np] | 93 | 1.36 |
| 镍 | [Ni] | 28 | 1.91 |
| 铌 | [Nb] | 41 | 1.6 |
| 氮 | [N] | 7 | 3.04 |
| 锘 | [No] | 102 | 1.3 |
| Oganesson | [Uuo] | 118 | |
| 锇 | [Os] | 76 | 2.2 |
| 氧 | [O] | 8 | 3.44 |
| 钯 | [Pd] | 46 | 2.2 |
| 磷 | [P] | 15 | 2.19 |
| 铂金 | [Pt] | 78 | 2.28 |
| 钚 | [Pu] | 94 | 1.28 |
| 钋 | [Po] | 84 | 2 |
| 钾 | [K] | 19 | 0.82 |
| 镨 | [Pr] | 59 | 1.13 |
| 钷 | [Pm] | 61 | |
| 镤 | [Pa] | 91 | 1.5 |
| 镭 | [Ra] | 88 | 0.9 |
| 氡 | [Rn] | 86 | |
| 铼 | [Re] | 75 | 1.9 |
| 铑 | [Rh] | 45 | 2.28 |
| 錀 | [Rg] | 111 | |
| 铷 | [Rb] | 37 | 0.82 |
| 钌 | [Ru] | 44 | 2.2 |
| 卢瑟福 | [Rf] | 104 | |
| 钐 | [Sm] | 62 | 1.17 |
| 钪 | [Sc] | 21 | 1.36 |
| Seaborgium | [Sg] | 106 | |
| 硒 | [Se] | 34 | 2.55 |
| 硅 | [Si] | 14 | 1.9 |
| 白银 | [Ag] | 47 | 1.93 |
| 钠 | [Na] | 11 | 0.93 |
| 锶 | [Sr] | 38 | 0.95 |
| 硫 | [S] | 16 | 2.58 |
| 钽 | [Ta] | 73 | 1.5 |
| 锝 | [Tc] | 43 | 1.9 |
| 碲 | [Te] | 52 | 2.1 |
| 铽 | [Tb] | 65 | |
| 铊 | [Tl] | 81 | 1.62 |
| 钍 | [Th] | 90 | 1.3 |
| 铥 | [Tm] | 69 | 1.25 |
| 锡 | [Sn] | 50 | 1.96 |
| 钛 | [Ti] | 22 | 1.54 |
| 钨 | [W] | 74 | 2.36 |
| 铁线莲 | [Uub] | 112 | |
| 无花果 | [Uuh] | 116 | |
| 未奔腾 | [Uup] | 115 | |
| 非四方 | [Uuq] | 114 | |
| 无菌 | [Uus] | 117 | |
| 乌云 | [Uut] | 113 | |
| 铀 | [U] | 92 | 1.38 |
| 钒 | [V] | 23 | 1.63 |
| 氙 | [Xe] | 54 | 2.6 |
| 镱 | [Yb] | 70 | |
| 钇 | [Y] | 39 | 1.22 |
| 锌 | [Zn] | 30 | 1.65 |
| 锆 | [Zr] | 40 | 1.33 |
咨询最多的元素!

由于电子配置,可以从原子的化学点建立结合的性质,因此,它在元素周期表中对应的位置是已知的。 这种配置表明了每个电子在不同能级中的顺序,即在轨道中,或者简单地显示了它们在原子核周围的分布。
为什么电子构型很重要?

电子离原子核越远,这个能级就越高。 当电子处于同一能级时,这个能级就称为能量轨道。 您可以使用本教育文本上方显示的表格检查所有元素的电子配置。
元素的电子配置也使用通过元素周期表获得的元素的原子序数。 为了详细研究这个有价值的话题,有必要知道电子是什么。
这种识别是由于每个电子具有四个量子数,即:
- 磁量子数:显示电子所在轨道的方向。
- 主量子数:它是电子所在的能级。
- 自旋量子数: 指电子的自旋。
- 方位角或次级量子数: 它是电子所在的轨道。
电子配置的目标。
电子构型的主要目的是阐明原子的有序和能量分布,尤其是各个能级和亚能级的分布。
电子配置的类型。
- 默认配置.

- 扩展配置. 由于这种配置,原子的每个电子都用箭头表示,以表示每个电子的自旋。 在这种情况下,填充是在考虑 Hund 的最大多重性规则和 Pauli 的排除原则的情况下完成的。
- 精简配置. 在标准配置中变满的所有能级都由惰性气体表示,其中气体的原子序数与填充最终能级的电子数之间存在对应关系。 这些惰性气体是:He、Ar、Ne、Kr、Rn 和 Xe。
- 半扩展配置. 它是扩展配置和压缩配置之间的混合。 其中,仅代表最后一个能级的电子。
书写原子电子构型的要点。
- 你必须知道原子有多少电子,因为你只需要知道它的原子序数,因为它等于电子的数量。
- 将电子放置在每个能级中,从最接近的开始。
- 尊重每个级别的最大容量。
获得元素电子构型的步骤

在这种情况下,元素周期表中的原子序数总是显示在右上方的方框中,例如,在氢的情况下,在这个方框的上部观察到的将是数字 1,而它的原子量或 masico number,是封闭在上部但在左侧的数字。
使用该原子序数会导致其配置通过使用量子数和轨道中电子的相应分布来确定
以下是元素配置的一些示例。
- 氢,其原子序数为1,即Z=1,因此,Z=1:1sa .
- 钾,它的原子序数是19,所以Z=19:1s其中2s其中2P63s其中3p64s其中3d十4pa.
电子传播。
它对应于每个电子在原子轨道和亚能级中的分布。 在这里,这些元素的电子配置由 Moeller 图控制。
为了确定每个元素的电子分布,只有符号必须从上到下和从右到左对角书写。
根据电子配置对元素进行分类。
所有化学元素分为四组,它们是:
- 稀有气体. 他们用八个电子完成了他们的电子轨道,不包括有两个电子的 He。
- 过渡元素. 他们的最后两个轨道不完整。
- 内部过渡元素. 它们的最后三个轨道不完整。
- 代表元素. 它们的外轨道不完整。
使用元素和化合物
由于元素的电子配置,可以知道原子在其轨道上的电子数量,这在建立离子、共价键和了解价电子时非常有用,最后对应于电子的数量某个元素的原子在其最后一个轨道或壳层中。
元素密度
所有物质都有质量和体积。但是不同物质的质量占据不同的体积。