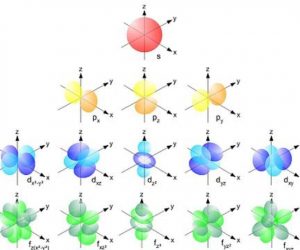
Az elektronkonfigurációt úgy írják le, hogy egy atom vagy ion összes elektronját megtalálják a pályájukon vagy az energia-alszinteken.
Emlékezzünk vissza, hogy 7 energiaszint létezik: 1, 2, 3, 4, 5, 6 és 7. És mindegyiknek legfeljebb 4 energia-alszintje van, ezek s, p , d és f.
Így az 1. szint csak s alszintet tartalmaz; a 2. szint syp alszinteket tartalmaz; a 3. szint az s, p és d alszinteket tartalmazza; és a 4-től 7-ig terjedő szintek az s, p, d és f alszinteket tartalmazzák.
Az elektron konfiguráció

Az elektronok különböző energiaszinteken való eloszlásának kiszámításához az Elektron konfiguráció referenciaként veszi a kvantumszámokat, vagy egyszerűen csak felhasználja őket az eloszláshoz. Ezek a számok lehetővé teszik az elektronok vagy egyetlen elektron energiaszintjének leírását, valamint az elektronok térbeli eloszlásában észlelt pályák alakját is.
Elem konfigurációs táblázat
| Elem neve | Szimbólum | Atomszám | elektronegativitás |
|---|---|---|---|
| Aktínium | [Ac] | 89 | 1.1 |
| Alumínium | [Al] | 13 | 1.61 |
| americium | [Am] | 95 | 1.3 |
| Antimon | [Sb] | 51 | 2.05 |
| Argon | [Ar] | 18 | |
| Arzén | [As] | 33 | 2.18 |
| asztácium | [At] | 85 | 2.2 |
| Bárium | [Ba] | 56 | 0.89 |
| Berkelium | [Bk] | 97 | 1.3 |
| berillium | [Be] | 4 | 1.57 |
| bizmut | [Bi] | 83 | 2.02 |
| Bohrium | [Bh] | 107 | |
| Bór | [B] | 5 | 2.04 |
| Bróm | [Br] | 35 | 2.96 |
| Kadmium | [Cd] | 48 | 1.69 |
| Kalcium | [Ca] | 20 | 1 |
| Kalifornium | [Cf] | 98 | 1.3 |
| Szén | [C] | 6 | 2.55 |
| Cérium | [Ce] | 58 | 1.12 |
| Cézium | [Cs] | 55 | 0.79 |
| Klór | [Cl] | 17 | 3.16 |
| Króm | [Cr] | 24 | 1.66 |
| Kobalt | [Co] | 27 | 1.88 |
| Réz | [Cu] | 29 | 1.9 |
| kűrium | [Cm] | 96 | 1.3 |
| Darmstadtium | [Ds] | 110 | |
| Dubnium | [Db] | 105 | |
| Diszprózium | [Dy] | 66 | 1.22 |
| einsteinium | [Es] | 99 | 1.3 |
| Erbium | [Er] | 68 | 1.24 |
| Europium | [Eu] | 63 | |
| fermium | [Fm] | 100 | 1.3 |
| Fluor | [F] | 9 | 3.98 |
| francium | [Fr] | 87 | 0.7 |
| Gadolínium | [Gd] | 64 | 1.2 |
| Gallium | [Ga] | 31 | 1.81 |
| Germánium | [Ge] | 32 | 2.01 |
| Arany | [Au] | 79 | 2.54 |
| Hafnium | [Hf] | 72 | 1.3 |
| Kálium | [Hs] | 108 | |
| Hélium | [He] | 2 | |
| Holmium | [Ho] | 67 | 1.23 |
| Hidrogén | [H] | 1 | 2.2 |
| Indium | [In] | 49 | 1.78 |
| Jód | [I] | 53 | 2.66 |
| Iridium | [Ir] | 77 | 2.2 |
| Vas | [Fe] | 26 | 1.83 |
| Krypton | [Kr] | 36 | 3 |
| Lantán | [La] | 57 | 1.1 |
| Lawrencium | [Lr] | 103 | |
| Vezet | [Pb] | 82 | 2.33 |
| Lítium | [Li] | 3 | 0.98 |
| Lutetium | [Lu] | 71 | 1.27 |
| Magnézium | [Mg] | 12 | 1.31 |
| Mangán | [Mn] | 25 | 1.55 |
| Meitnerium | [Mt] | 109 | |
| mendelévium | [Md] | 101 | 1.3 |
| Merkúr | [Hg] | 80 | 2 |
| Molibdén | [Mo] | 42 | 2.16 |
| neodímium | [Nd] | 60 | 1.14 |
| Neon | [Ne] | 10 | |
| neptúnium | [Np] | 93 | 1.36 |
| Nikkel | [Ni] | 28 | 1.91 |
| Nióbium | [Nb] | 41 | 1.6 |
| Nitrogén | [N] | 7 | 3.04 |
| Nobelium | [No] | 102 | 1.3 |
| Oganesson | [Uuo] | 118 | |
| Ozmium | [Os] | 76 | 2.2 |
| Oxigén | [O] | 8 | 3.44 |
| palládium | [Pd] | 46 | 2.2 |
| Foszfor | [P] | 15 | 2.19 |
| Platina | [Pt] | 78 | 2.28 |
| Plutónium | [Pu] | 94 | 1.28 |
| Polónium | [Po] | 84 | 2 |
| Kálium | [K] | 19 | 0.82 |
| Prazeodímium | [Pr] | 59 | 1.13 |
| Prométium | [Pm] | 61 | |
| protaktínium | [Pa] | 91 | 1.5 |
| rádium | [Ra] | 88 | 0.9 |
| Radon | [Rn] | 86 | |
| Rénium | [Re] | 75 | 1.9 |
| Ródium | [Rh] | 45 | 2.28 |
| Roentgenium | [Rg] | 111 | |
| Rubídium | [Rb] | 37 | 0.82 |
| Ruténium | [Ru] | 44 | 2.2 |
| Rutherfordium | [Rf] | 104 | |
| Szamárium | [Sm] | 62 | 1.17 |
| Scandium | [Sc] | 21 | 1.36 |
| sziborgium | [Sg] | 106 | |
| Szelén | [Se] | 34 | 2.55 |
| Szilícium | [Si] | 14 | 1.9 |
| Ezüst | [Ag] | 47 | 1.93 |
| Nátrium | [Na] | 11 | 0.93 |
| Stroncium | [Sr] | 38 | 0.95 |
| Kén | [S] | 16 | 2.58 |
| Tantál | [Ta] | 73 | 1.5 |
| technécium | [Tc] | 43 | 1.9 |
| Tellúr | [Te] | 52 | 2.1 |
| Terbium | [Tb] | 65 | |
| Tallium | [Tl] | 81 | 1.62 |
| tórium | [Th] | 90 | 1.3 |
| Túlium | [Tm] | 69 | 1.25 |
| Ón | [Sn] | 50 | 1.96 |
| Titán | [Ti] | 22 | 1.54 |
| Volfrám | [W] | 74 | 2.36 |
| Ununbium | [Uub] | 112 | |
| Ununhexium | [Uuh] | 116 | |
| Ununpentium | [Uup] | 115 | |
| Ununquadium | [Uuq] | 114 | |
| Ununseptium | [Uus] | 117 | |
| Ununtrium | [Uut] | 113 | |
| Uránium | [U] | 92 | 1.38 |
| Vanádium | [V] | 23 | 1.63 |
| xenon | [Xe] | 54 | 2.6 |
| Itterbium | [Yb] | 70 | |
| Ittrium | [Y] | 39 | 1.22 |
| cink | [Zn] | 30 | 1.65 |
| Cirkónium | [Zr] | 40 | 1.33 |
A legtöbbet konzultált elemek!

Az Elektron konfigurációnak köszönhetően az atomok kémiai pontjáról meg lehet állapítani a kombináció tulajdonságait, ennek köszönhetően ismert a periódusos rendszerben ennek megfelelő hely. Ez a konfiguráció jelzi az egyes elektronok sorrendjét a különböző energiaszinteken, azaz a pályákon, vagy egyszerűen csak az atommag körüli eloszlásukat mutatja.
Miért fontos az elektronkonfiguráció?

Minél távolabb van az elektron az atommagtól, annál magasabb lesz ez az energiaszint. Ha az elektronok ugyanazon az energiaszinten vannak, akkor ez a szint energiapályák nevét veszi fel. Az összes elem elektronkonfigurációját a jelen oktatási szöveg felett megjelenő táblázat segítségével ellenőrizheti.
Az elemek elektronkonfigurációja az elem rendszámát is használja, amelyet a periódusos rendszeren keresztül kapunk meg. Ennek az értékes témának a részletes tanulmányozásához tudnia kell, mi az elektron.
Ez az azonosítás az egyes elektronokkal rendelkező négy kvantumszámnak köszönhető, nevezetesen:
- mágneses kvantumszám: mutatja annak a pályának a tájolását, amelyen az elektron található.
- fő kvantumszám: az az energiaszint, amelyben az elektron található.
- Spin kvantumszám: az elektron spinére utal.
- Azimutális vagy másodlagos kvantumszám: ez az a pálya, amelyen az elektron található.
Az elektronkonfiguráció céljai.
Az elektronkonfiguráció fő célja az atomok sorrendjének és energiaeloszlásának tisztázása, különös tekintettel az egyes energiaszintek és alszintek eloszlására.
Az elektronkonfiguráció típusai.
- Alapértelmezett konfiguráció.

- Kibővített konfiguráció. Ennek a konfigurációnak köszönhetően egy atom minden elektronja nyilakkal ábrázolva van, amelyek mindegyikének spinjét ábrázolják. Ebben az esetben a kitöltés a Hund-féle maximális multiplicitás-szabály és a Pauli-féle kizárási elv figyelembevételével történik.
- sűrített konfiguráció. Minden olyan szintet, amely a standard konfigurációban megtelt, nemesgáz képvisel, ahol a gáz rendszáma és a végső szintet kitöltő elektronok száma között megfeleltetés van. Ezek a nemesgázok: He, Ar, Ne, Kr, Rn és Xe.
- Félig kibővített konfiguráció. Ez a kiterjesztett konfiguráció és a sűrített konfiguráció keveréke. Ebben csak az utolsó energiaszint elektronjai vannak ábrázolva.
Főbb pontok az atom elektronkonfigurációjának megírásához.
- Tudnia kell az atomok elektronjainak számát, ehhez csak a rendszámát kell tudnia, mivel ez megegyezik az elektronok számával.
- Helyezze az elektronokat minden energiaszintre, a legközelebbitől kezdve.
- Tartsa be az egyes szintek maximális kapacitását.
Lépések egy elem elektronkonfigurációjának meghatározásához

Ebben az esetben a periódusos rendszer rendszáma mindig a jobb felső mezőben van feltüntetve, például a hidrogén esetében ennek a négyzetnek a felső részében az 1-es lesz, míg az atomtömege vagy masico szám, az a szám, amely a felső részbe van zárva, de a bal oldalon.
Ennek az atomszámnak a használata azt eredményezi, hogy konfigurációját kvantumszámok és az elektronok megfelelő eloszlása alapján határozzák meg a pályán
Íme néhány példa az elemek konfigurációjára.
- Hidrogén, rendszáma 1, azaz Z=1, tehát Z=1:1sa .
- Kálium, rendszáma 19, tehát Z=19: 1stőlük2stőlük2P63stőlük3p64stőlük3dtíz4pa.
Elektrondisszemináció.
Ez megfelel az egyes elektronok eloszlásának egy atom pályáján és alszintjein. Itt ezen elemek elektronkonfigurációját a Moeller-diagram szabályozza.
Az egyes elemek elektroneloszlásának meghatározásához csak a jelöléseket kell átlósan felírni felülről lefelé és jobbról balra.
Az elemek osztályozása elektronkonfiguráció szerint.
Minden kémiai elem négy csoportba sorolható, ezek:
- nemesgázok. Nyolc elektronnal fejezték be elektronpályájukat, nem számítva a He-t, amelynek két elektronja van.
- átmeneti elemek. Utolsó két pályájuk hiányos.
- Belső átmeneti elemek. Ezeknek az utolsó három pályájuk hiányos.
- reprezentatív elem. Ezeknek hiányos külső pályájuk van.
Munka elemekkel és vegyületekkel
Az elemek elektron konfigurációjának köszönhetően meg lehet tudni, hogy az atomok pályájukon hány elektron van, ami nagyon hasznos ionos, kovalens kötések felépítésénél és a vegyértékelektronok ismeretében, ez utóbbi megfelel az elektronok számának. hogy egy bizonyos elem atomja az utolsó pályáján vagy héján van.
Elemek Desnity
Minden anyagnak van tömege és térfogata, azonban a különböző anyagok tömege eltérő térfogatot foglal el.