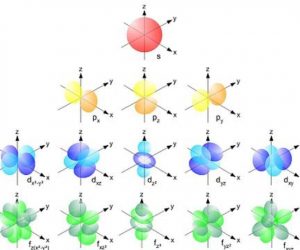
इलेक्ट्रॉन कॉन्फिगरेशन अणू किंवा आयनचे सर्व इलेक्ट्रॉन त्यांच्या कक्षा किंवा उर्जा उपस्तरांमध्ये शोधून लिहिले जाते.
लक्षात ठेवा की 7 उर्जा पातळी आहेत: 1, 2, 3, 4, 5, 6 आणि 7. आणि त्या प्रत्येकामध्ये, s, p, d आणि f नावाच्या 4 पर्यंत ऊर्जा उप-स्तर आहेत.
अशा प्रकारे, स्तर 1 मध्ये फक्त सबलेव्हल s समाविष्ट आहे; स्तर 2 मध्ये syp सबलेव्हल्स आहेत; स्तर 3 मध्ये उप-स्तर s, p आणि d समाविष्ट आहेत; आणि स्तर 4 ते 7 मध्ये s, p, d आणि f हे उपस्तर आहेत.
इलेक्ट्रॉन कॉन्फिगरेशन

वेगवेगळ्या ऊर्जा स्तरांमध्ये इलेक्ट्रॉनच्या वितरणाची गणना करण्यासाठी, इलेक्ट्रॉन कॉन्फिगरेशन संदर्भ म्हणून क्वांटम संख्या घेते किंवा वितरणासाठी त्यांचा वापर करते. हे आकडे आपल्याला इलेक्ट्रॉन किंवा एका इलेक्ट्रॉनच्या ऊर्जेच्या पातळीचे वर्णन करण्यास अनुमती देतात, ते अंतराळातील इलेक्ट्रॉनच्या वितरणामध्ये जाणवणाऱ्या ऑर्बिटल्सच्या आकाराचे देखील वर्णन करतात.
घटक कॉन्फिगरेशन सारणी
| घटक नाव | प्रतीक | अणु संख्या | विद्युतप्रवाहता |
|---|---|---|---|
| अॅक्टिनियम | [Ac] | 89 | 1.1 |
| अॅल्युमिनियम | [Al] | 13 | 1.61 |
| अमेरिकियम | [Am] | 95 | 1.3 |
| सुरमा | [Sb] | 51 | 2.05 |
| आर्गॉन | [Ar] | 18 | |
| आर्सेनिक | [As] | 33 | 2.18 |
| अस्टॅटिन | [At] | 85 | 2.2 |
| रुप्यासारखा पांढरा मऊ धातू | [Ba] | 56 | 0.89 |
| बर्कीलियम | [Bk] | 97 | 1.3 |
| बेअरिलियम | [Be] | 4 | 1.57 |
| बिस्मथ | [Bi] | 83 | 2.02 |
| बोहरियम | [Bh] | 107 | |
| बोरॉन | [B] | 5 | 2.04 |
| ब्रोमाईन | [Br] | 35 | 2.96 |
| कॅडमियम | [Cd] | 48 | 1.69 |
| कॅल्शियम | [Ca] | 20 | 1 |
| कॅलिफोर्नियम | [Cf] | 98 | 1.3 |
| कार्बन | [C] | 6 | 2.55 |
| cerium | [Ce] | 58 | 1.12 |
| सेझियम | [Cs] | 55 | 0.79 |
| क्लोरीन | [Cl] | 17 | 3.16 |
| Chromium | [Cr] | 24 | 1.66 |
| कोबाल्ट | [Co] | 27 | 1.88 |
| तांबे | [Cu] | 29 | 1.9 |
| कूरियम | [Cm] | 96 | 1.3 |
| डर्मस्टॅडियम | [Ds] | 110 | |
| डबनिअम | [Db] | 105 | |
| डिस्प्रोसियम | [Dy] | 66 | 1.22 |
| आइन्स्टेनियम | [Es] | 99 | 1.3 |
| एर्बियम | [Er] | 68 | 1.24 |
| युरोपियम | [Eu] | 63 | |
| फर्मियम | [Fm] | 100 | 1.3 |
| फ्लोरिन | [F] | 9 | 3.98 |
| फ्रँशियम | [Fr] | 87 | 0.7 |
| गॅडोलिनियम | [Gd] | 64 | 1.2 |
| गॅलियम | [Ga] | 31 | 1.81 |
| जर्मेनियम | [Ge] | 32 | 2.01 |
| गोल्ड | [Au] | 79 | 2.54 |
| हाफ्नियम | [Hf] | 72 | 1.3 |
| हासियम | [Hs] | 108 | |
| हीलियम | [He] | 2 | |
| होल्मियम | [Ho] | 67 | 1.23 |
| हायड्रोजन | [H] | 1 | 2.2 |
| इंडियम | [In] | 49 | 1.78 |
| आयोडीन | [I] | 53 | 2.66 |
| एक रूपेरी रंगाचा चकचकीत धातू | [Ir] | 77 | 2.2 |
| लोह | [Fe] | 26 | 1.83 |
| Krypton | [Kr] | 36 | 3 |
| लॅन्थेनम | [La] | 57 | 1.1 |
| लॉरेनियम | [Lr] | 103 | |
| लीड | [Pb] | 82 | 2.33 |
| लिथियम | [Li] | 3 | 0.98 |
| ल्यूटियम | [Lu] | 71 | 1.27 |
| मॅग्नेशियम | [Mg] | 12 | 1.31 |
| मँगेनिझ | [Mn] | 25 | 1.55 |
| मीटनेरियम | [Mt] | 109 | |
| मेंडेलेव्हियम | [Md] | 101 | 1.3 |
| बुध | [Hg] | 80 | 2 |
| मोलिब्डेनम | [Mo] | 42 | 2.16 |
| Neodymium | [Nd] | 60 | 1.14 |
| नियॉन | [Ne] | 10 | |
| नेपचुनियम | [Np] | 93 | 1.36 |
| निकेल | [Ni] | 28 | 1.91 |
| निओबियम | [Nb] | 41 | 1.6 |
| नायट्रोजन | [N] | 7 | 3.04 |
| नोबेलियम | [No] | 102 | 1.3 |
| ओगनेसन | [Uuo] | 118 | |
| Osmium | [Os] | 76 | 2.2 |
| ऑक्सिजन | [O] | 8 | 3.44 |
| पॅलॅडियम | [Pd] | 46 | 2.2 |
| फॉस्फरस | [P] | 15 | 2.19 |
| प्लॅटिनम | [Pt] | 78 | 2.28 |
| प्लुटोनियम | [Pu] | 94 | 1.28 |
| पोलोनियम | [Po] | 84 | 2 |
| पोटॅशिअम | [K] | 19 | 0.82 |
| प्रोसेओडीमियम | [Pr] | 59 | 1.13 |
| प्रोमिथियम | [Pm] | 61 | |
| प्रोटेक्टिनियम | [Pa] | 91 | 1.5 |
| बहुमोल | [Ra] | 88 | 0.9 |
| radon | [Rn] | 86 | |
| रेनिअम | [Re] | 75 | 1.9 |
| रोडिअम | [Rh] | 45 | 2.28 |
| रोएंटजेनियम | [Rg] | 111 | |
| Rubidium | [Rb] | 37 | 0.82 |
| रुतनियम | [Ru] | 44 | 2.2 |
| रदरफोर्डियम | [Rf] | 104 | |
| Samarium | [Sm] | 62 | 1.17 |
| स्कॅन्डियम | [Sc] | 21 | 1.36 |
| सीबोर्जियम | [Sg] | 106 | |
| सेलेनियम | [Se] | 34 | 2.55 |
| सिलिकॉन | [Si] | 14 | 1.9 |
| चांदी | [Ag] | 47 | 1.93 |
| सोडियम | [Na] | 11 | 0.93 |
| स्ट्रोंटियम | [Sr] | 38 | 0.95 |
| सल्फर | [S] | 16 | 2.58 |
| टँटलम | [Ta] | 73 | 1.5 |
| टेकनेटिअम | [Tc] | 43 | 1.9 |
| टेलूरियम | [Te] | 52 | 2.1 |
| terbium | [Tb] | 65 | |
| थेलियम | [Tl] | 81 | 1.62 |
| थोरियम | [Th] | 90 | 1.3 |
| थुलियम | [Tm] | 69 | 1.25 |
| कथील | [Sn] | 50 | 1.96 |
| टायटॅनियम | [Ti] | 22 | 1.54 |
| टंगस्टन | [W] | 74 | 2.36 |
| Ununbium | [Uub] | 112 | |
| Ununhexium | [Uuh] | 116 | |
| अनपेन्टियम | [Uup] | 115 | |
| Ununquadium | [Uuq] | 114 | |
| अनसेप्टियम | [Uus] | 117 | |
| अनंट्रिअम | [Uut] | 113 | |
| युरेनियम धातू | [U] | 92 | 1.38 |
| वॅनडीयम | [V] | 23 | 1.63 |
| झेनॉन | [Xe] | 54 | 2.6 |
| ytterbium | [Yb] | 70 | |
| यिट्रियम | [Y] | 39 | 1.22 |
| झिंक | [Zn] | 30 | 1.65 |
| झिरकोनियम | [Zr] | 40 | 1.33 |
सर्वात सल्लामसलत घटक!

इलेक्ट्रॉन कॉन्फिगरेशनमुळे, अणूंच्या रासायनिक बिंदूपासून संयोगाचे गुणधर्म स्थापित करणे शक्य आहे, यामुळे, आवर्त सारणीमध्ये त्याच्याशी संबंधित स्थान ज्ञात आहे. हे कॉन्फिगरेशन प्रत्येक इलेक्ट्रॉनचा क्रम वेगवेगळ्या उर्जा स्तरांमध्ये, म्हणजे कक्षामध्ये दर्शवते किंवा अणूच्या केंद्रकाभोवती त्यांचे वितरण दर्शवते.
इलेक्ट्रॉन कॉन्फिगरेशन महत्वाचे का आहे?

न्यूक्लियसपासून इलेक्ट्रॉन जितके दूर असेल तितकी ही ऊर्जा पातळी जास्त असेल. जेव्हा इलेक्ट्रॉन समान उर्जा स्तरावर असतात तेव्हा या पातळीला उर्जा ऑर्बिटल्स असे नाव दिले जाते. या शैक्षणिक मजकुराच्या वर दिसणार्या सारणीचा वापर करून तुम्ही सर्व घटकांचे इलेक्ट्रॉन कॉन्फिगरेशन तपासू शकता.
घटकांचे इलेक्ट्रॉन कॉन्फिगरेशन नियतकालिक सारणीद्वारे प्राप्त केलेल्या घटकाच्या अणुक्रमांकाचा देखील वापर करते. या मौल्यवान विषयाचा तपशीलवार अभ्यास करण्यासाठी इलेक्ट्रॉन म्हणजे काय हे जाणून घेणे आवश्यक आहे.
ही ओळख प्रत्येक इलेक्ट्रॉनच्या चार क्वांटम संख्यांमुळे केली जाते, म्हणजे:
- चुंबकीय क्वांटम संख्या: इलेक्ट्रॉन ज्यामध्ये स्थित आहे त्या कक्षाचे अभिमुखता दर्शविते.
- मुख्य क्वांटम क्रमांक: ही ऊर्जा पातळी आहे ज्यामध्ये इलेक्ट्रॉन स्थित आहे.
- स्पिन क्वांटम क्रमांक: इलेक्ट्रॉनच्या स्पिनचा संदर्भ देते.
- अझीमुथल किंवा दुय्यम क्वांटम संख्या: ही कक्षा आहे ज्यामध्ये इलेक्ट्रॉन स्थित आहे.
इलेक्ट्रॉन कॉन्फिगरेशनची उद्दिष्टे.
इलेक्ट्रॉन कॉन्फिगरेशनचा मुख्य उद्देश म्हणजे अणूंचा क्रम आणि ऊर्जा वितरण, विशेषत: प्रत्येक ऊर्जा पातळी आणि सबलेव्हलचे वितरण स्पष्ट करणे.
इलेक्ट्रॉन कॉन्फिगरेशनचे प्रकार.
- डीफॉल्ट कॉन्फिगरेशन.

- विस्तारित कॉन्फिगरेशन. या कॉन्फिगरेशनबद्दल धन्यवाद, अणूचे प्रत्येक इलेक्ट्रॉन प्रत्येकाच्या स्पिनचे प्रतिनिधित्व करण्यासाठी बाण वापरून प्रस्तुत केले जाते. या प्रकरणात, हंडचा जास्तीत जास्त गुणाकार नियम आणि पॉलीचे बहिष्कार तत्त्व लक्षात घेऊन भरणे केले जाते.
- कंडेन्स्ड कॉन्फिगरेशन. मानक कॉन्फिगरेशनमध्ये पूर्ण होणारे सर्व स्तर उदात्त वायूद्वारे दर्शविले जातात, जेथे गॅसचा अणुक्रमांक आणि अंतिम स्तर भरलेल्या इलेक्ट्रॉन्सच्या संख्येमध्ये एक पत्रव्यवहार असतो. हे उदात्त वायू आहेत: He, Ar, Ne, Kr, Rn आणि Xe.
- अर्ध-विस्तारित कॉन्फिगरेशन. हे विस्तारित कॉन्फिगरेशन आणि कंडेन्स्ड कॉन्फिगरेशनमधील मिश्रण आहे. त्यामध्ये, केवळ शेवटच्या उर्जा पातळीचे इलेक्ट्रॉन दर्शविलेले आहेत.
अणूचे इलेक्ट्रॉन कॉन्फिगरेशन लिहिण्यासाठी मुख्य मुद्दे.
- तुम्हाला अणूमध्ये किती इलेक्ट्रॉन्स आहेत हे माहित असणे आवश्यक आहे, त्यासाठी तुम्हाला फक्त त्याचा अणुक्रम माहित असणे आवश्यक आहे कारण ही संख्या इलेक्ट्रॉनच्या संख्येइतकी आहे.
- जवळच्यापासून सुरुवात करून, प्रत्येक ऊर्जा स्तरावर इलेक्ट्रॉन ठेवा.
- प्रत्येक स्तराच्या कमाल क्षमतेचा आदर करा.
घटकाचे इलेक्ट्रॉन कॉन्फिगरेशन मिळविण्यासाठी पायऱ्या

या प्रकरणात, नियतकालिक सारणीतील अणुक्रमांक नेहमी वरच्या उजव्या बॉक्समध्ये दर्शविला जातो, उदाहरणार्थ, हायड्रोजनच्या बाबतीत, तो या बॉक्सच्या वरच्या भागात दिसलेला क्रमांक 1 असेल, तर त्याचे अणू वजन किंवा masico क्रमांक, वरच्या भागात पण डाव्या बाजूला बंद केलेला आहे.
या अणुक्रमांकाच्या वापरामुळे त्याचे कॉन्फिगरेशन क्वांटम संख्यांच्या वापराद्वारे आणि कक्षातील इलेक्ट्रॉनच्या संबंधित वितरणाद्वारे निश्चित केले जाते.
येथे घटक कॉन्फिगरेशनची काही उदाहरणे आहेत.
- हायड्रोजन, त्याची अणुक्रमांक 1 आहे, म्हणजे Z=1, म्हणून, Z=1:1sa .
- पोटॅशियम, त्याची अणुक्रमांक 19 आहे, म्हणून Z=19: 1sत्यांना2sत्यांना2P63sत्यांना3p64sत्यांना3dदहा4pa.
इलेक्ट्रॉन प्रसार.
हे ऑर्बिटल्स आणि अणूच्या उप-स्तरांमधील प्रत्येक इलेक्ट्रॉनच्या वितरणाशी संबंधित आहे. येथे या घटकांचे इलेक्ट्रॉन कॉन्फिगरेशन मोएलर आकृतीद्वारे नियंत्रित केले जाते.
प्रत्येक घटकाचे इलेक्ट्रॉन वितरण निश्चित करण्यासाठी, फक्त नोटेशन्स वरपासून खालपर्यंत आणि उजवीकडून डावीकडे तिरपे लिहिल्या पाहिजेत.
इलेक्ट्रॉन कॉन्फिगरेशननुसार घटकांचे वर्गीकरण.
सर्व रासायनिक घटकांचे चार गटांमध्ये वर्गीकरण केले आहे, ते आहेत:
- उदात्त वायू. त्यांनी त्यांची इलेक्ट्रॉन कक्षा आठ इलेक्ट्रॉन्ससह पूर्ण केली, ज्यात दोन इलेक्ट्रॉन आहेत त्याला मोजले नाही.
- संक्रमण घटक. त्यांच्या शेवटच्या दोन कक्षा अपूर्ण आहेत.
- अंतर्गत संक्रमण घटक. त्यांच्या शेवटच्या तीन कक्षा अपूर्ण आहेत.
- प्रतिनिधी घटक. त्यांची बाह्य कक्षा अपूर्ण असते.
घटक आणि संयुगे सह कार्य करणे
घटकांच्या इलेक्ट्रॉन कॉन्फिगरेशनबद्दल धन्यवाद, अणूंच्या कक्षामध्ये किती इलेक्ट्रॉन आहेत हे जाणून घेणे शक्य आहे, जे आयनिक, सहसंयोजक बंध तयार करताना आणि व्हॅलेन्स इलेक्ट्रॉन जाणून घेताना खूप उपयुक्त ठरते, हे शेवटचे इलेक्ट्रॉनच्या संख्येशी संबंधित आहे. विशिष्ट घटकाचा अणू त्याच्या शेवटच्या कक्षेत किंवा शेलमध्ये असतो.
घटकांची घनता
सर्व पदार्थांचे वस्तुमान आणि आकारमान असते. तथापि भिन्न पदार्थांचे वस्तुमान वेगवेगळे खंड व्यापतात.